诺奖团队最新Cell:细菌的这种免疫防御系统,还可以感知DNA损伤
来源:生物谷
CRISPR基因编辑先驱、2020年诺贝尔化学奖得主、加州大学伯克利分校的 Jennifer Doudna 教授团队在 Cell 期刊发表了题为:Genome integrity sensing by the broad-spectrum Hachiman antiphage defense complex 的研究论文。
该研究发现,原核生物存在一种名为Hachiman的广谱抗噬菌体防御系统。Hachiman与古菌和真核生物的DNA解旋酶同源,通过不加区分的DNA降解抑制噬菌体复制。在没有噬菌体的情况下,Hachiman能感知基因组的完整性,并对异常的DNA状态作出反应。此外,Hachiman解旋酶与真核生物和古菌中的酶之间的系统发育相似性表明,在生命的各域中Hachiman解旋酶与其他重要解旋酶之间具有深层的功能相似性。

DNA解旋酶通过“感知”病原体相关分子模式(PAMP)参与先天性和适应性免疫系统。最近的多项研究发现,许多原核生物(细菌)的抗病毒防御系统编码DNA解旋酶,并且这些解旋酶与真核生物中的多种参与免疫调节的DNA解旋酶同源。
Hachiman正是这样一种广谱噬菌体防御系统(Hachiman一词来自日本文化中的守护神——八幡神),它是一个双基因位点,编码HamA(一种功能未知的蛋白质,DUF1837)和超家族2(SF2)Ski-2样解旋酶HamB。Hachiman存在于超过5%的原核生物基因组中,并且能够对广泛种类的不同噬菌体提供强大的保护,但目前Hachiman的具体功能及其分子机制尚未被表征。
在这项最新研究中,研究团队首先证明,Hachiman是一个异二聚体核酸酶-解旋酶复合体——HamAB。其中,HamA是一种效应核酸酶,而HamB是解旋酶传感器,在完整双链DNA(dsDNA)的监测过程中,HamB限制了HamA的活性。
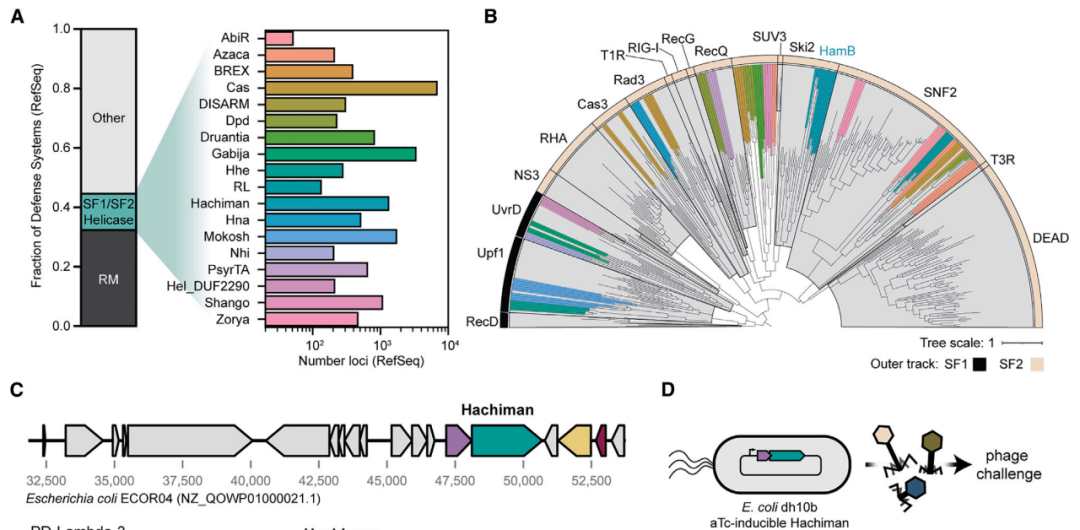
Hachiman是一种双组分的防御系统,可以抵御不同的噬菌体
噬菌体的DNA复制依赖同源重组,这一过程通常产生游离的ssDNA末端,并成为HamB的识别底物。冷冻电镜结构测定结果显示,HamAB复合物以不同模式结合DNA并促进噬菌体免疫:在识别游离的ssDNA末端后,HamB“棘轮”的构象变化调节了HamB的界面,由此激活了HamA的DNA降解活性。
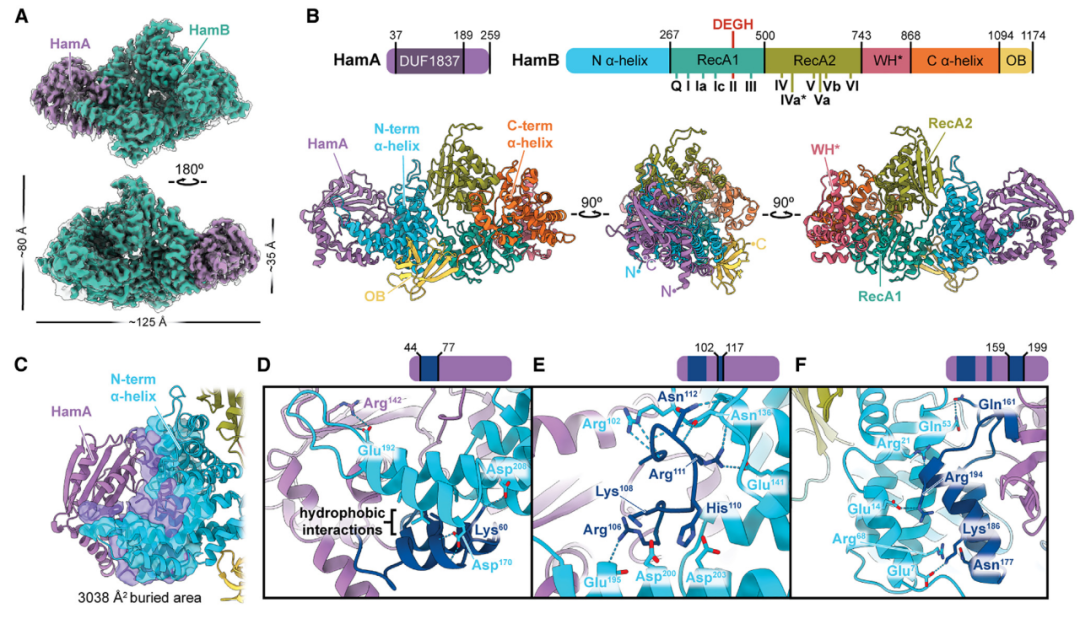
Hachiman络合的结构基础及活性位点的鉴定
简单来说,当HamAB复合物检测到DNA损伤时,HamB解旋酶活性激活HamAB,并释放核酸酶活性。有趣的是,原位荧光显微镜显示,Hachiman的激活会降解细胞中的所有DNA,产生一种既没有噬菌体DNA,也没有宿主DNA的“幽灵”细胞。
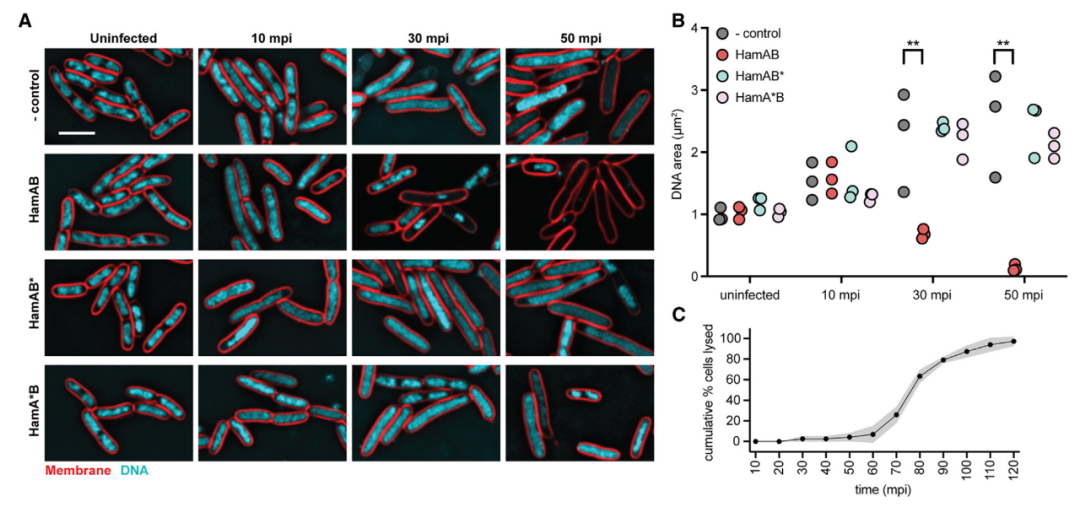
Hachiman通过非特异性DNA清除来抵御噬菌体
在进一步的研究中,研究团队发现,即使在没有噬菌体的情况下,Hachiman也会被DNA损伤剂激活,这表明Hachiman可以感应异常DNA状态并作出反应。生化和结构数据表明,ATP结合的HamAB可以感应基因组的完整性,当DNA损伤超过正常阈值时就能激活HamA的核酸酶活性。
在一方面,HamA的核酸酶活性可能为Hachiman结合和激活创造额外的位点,导致免疫信号的扩增,并最终限制系统发育多样性的噬菌体的侵袭。在另一方面,HamB解旋酶结构域的组织及其调节HamA效应物的能力使受控激活成为可能,这可能是其他含解旋酶的防御途径的一个原理。
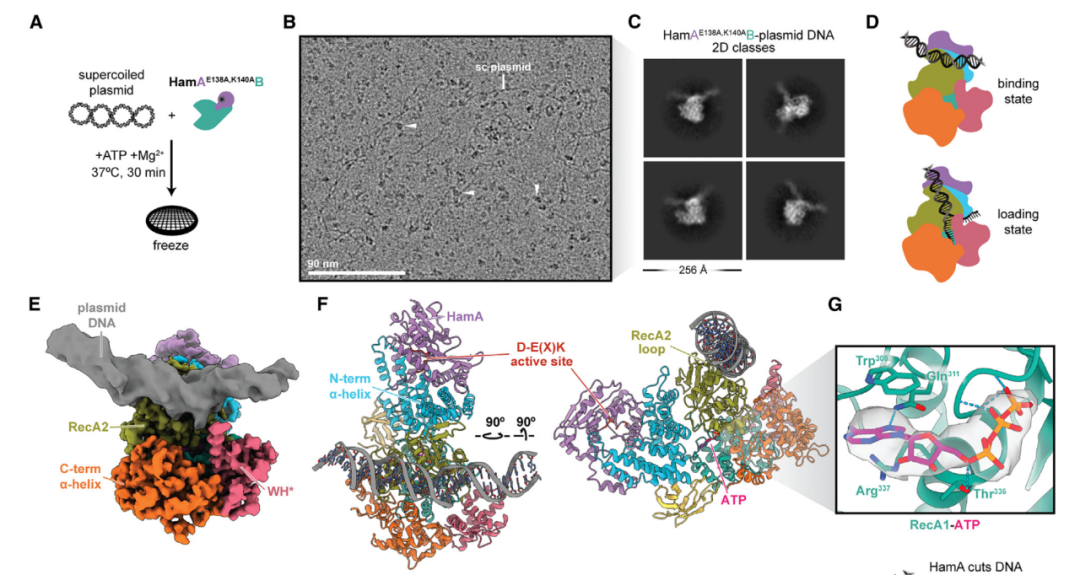
Hachiman监测基因组的完整性
总而言之,这项发表于 Cell 的研究全面表征了广谱噬菌体防御系统Hachiman的结构、功能和分子机制,并表明基因组完整性是噬菌体感染过程中的重要战场。Hachiman在进化上被调整为感应噬菌体入侵或者是严重的DNA损伤,并导致细胞内DNA的快速降解,从而阻断噬菌体感染和扩散。
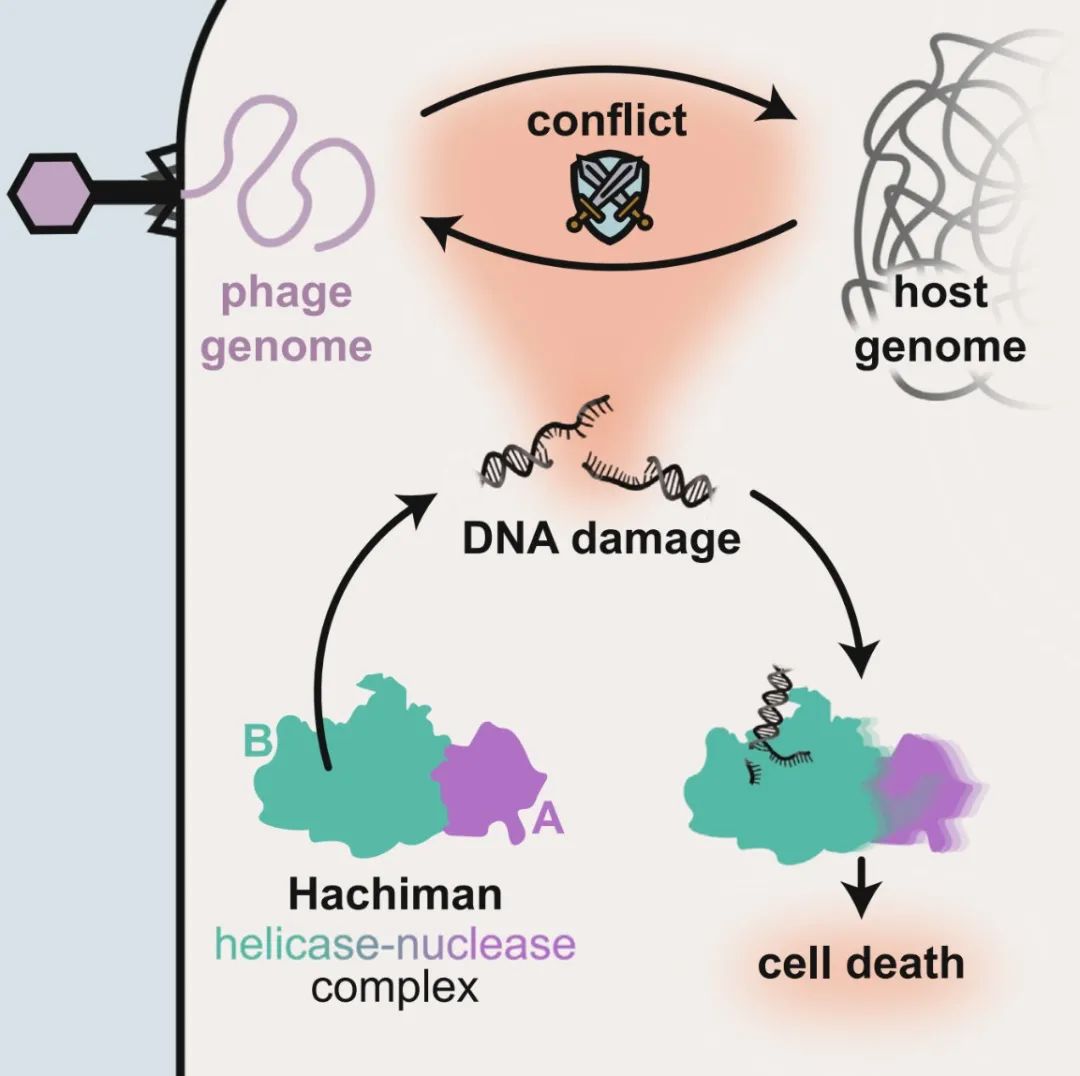
研究模式图
值得一提的是,Hachiman与真核生物及古菌的DNA解旋酶同源,因此其他防御系统可能会像Hachiman一样对细胞应激源做出反应,包括但不限于噬菌体感染。这些发现证明了Hachiman等DNA解旋酶同源物在广泛物种中具有深层次的功能相似性,揭示了原核生物抵抗噬菌体侵袭的防御机制。


